Уравнение состояния идеального газа
Уравнение состояния идеального газа
Взяли порцию газа некоторой массы и начали проводить над ней эксперименты. Например, изменяли некоторый параметр (например, температуру T) и наблюдали, как изменяются другие два параметра (объем V и давление p). При увеличении температуры, молекулы двигаются быстрее, соударения происходят чаще, значит, давление увеличивается и газ стремится занять больший объем. Или, если уменьшить объем, то частицам газа становится тесно, они чаще соударяются, увеличивается давление, а от большого числа соударений их скорость может увеличиваться, то есть может увеличиться температура.
Интуитивно пришли к зависимости трех макропараметров газа, которую вывел французский физик Б. Клапейрон
 или
или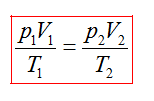

В любом состоянии одной и той же порции газа величина  остается постоянной.
остается постоянной.
 остается постоянной.
остается постоянной.Д.И. Менделеев исследовал влияние изменения массы газы на макропараметры. Получил зависимость, которое носит название уравнение Менделеева-Клапейрона, оно же уравнение состояния идеального газа



Используя формулы химических характеристик вещества, основное уравнение возможно записать в ином эквивалентном виде.
Комментариев нет:
Отправить комментарий